高速原子力显微镜研究本质上无序的蛋白质
我们对生物蛋白质的理解并不总是与它们的普遍性或重要性有关。一半的蛋白质,即在细胞过程中发挥不可或缺作用的分子,本质上是无序的,这意味着许多用于探测生物分子的标准技术对它们不起作用。现在,金泽大学的研究人员表明,他们自主研发的高速原子力显微镜技术不仅可以提供有关这些蛋白质结构的信息,还可以提供有关其动力学的信息。
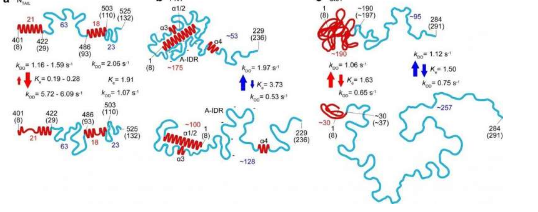
了解蛋白质如何组合在一起为了解其功能提供了宝贵的线索。1930 年代和 1950 年代蛋白质晶体学的发展首次将几种蛋白质结构带入了视野,但逐渐变得明显的是,很大一部分蛋白质缺乏单一的结构,使 X 射线晶体学难以处理。因为它们对于电子显微镜来说太薄了,许多这些固有无序蛋白质 (IDP) 的唯一可行替代品是核磁共振成像和小角度 X 射线散射。从这些技术收集的数据在整体上取平均值,因此没有明确指示单个蛋白质构象或它们出现的频率。另一方面,原子力显微镜能够高速进行纳米级分辨率的生物成像,因此它可以捕获动力学以及蛋白质结构。
在这项最新工作中,金泽大学的研究人员与、法国和的合作者一起将该技术应用于几个 IDP 的研究,并确定了定义蛋白质区域形状、大小和链长的参数,以及与蛋白质大小相关的幂律蛋白质长度,以及云母表面对蛋白质尺寸影响的定量描述。由于该技术的高速能力,捕获的蛋白质构象的动态揭示了出现和消失的小球,以及在长达 160 个氨基酸的片段中完全非结构化和松散折叠构象之间的转换。
对麻疹病毒核蛋白的研究尤其有助于确定负责分子识别的区域的有序-无序转变的形状和尺寸,以及特征,这使病毒能够识别宿主因素,以便它们可以繁殖。他们还可以确定核磁共振无法获得的病毒磷蛋白的更大规模结构(这只能表明氨基酸之间的距离小于 2 nm)。研究人员认为,观察到的某些紧凑形状的形成可以解释对蛋白质水解的抵抗力——蛋白质分解。
在他们的工作报告中,研究人员强调了这一点以及它本身的强大工具,“当 HS-AFM 揭示的所有分子特征与 NMR 给出的折叠局部结构相结合时,结合的信息允许定量描述与单独描绘的图片相比,以更真实的方式展示了 IDP 的结构和动态特征,如 PNT [麻疹病毒磷蛋白] 所证明的那样。”
高速原子力显微镜
原子力显微镜是在 1980 年代开发的,并将通过扫描隧道显微镜(获得 1986 年诺贝尔物理学奖)实现的原子级分辨率带到非导电样品。它的工作原理是使用末端带有纳米级尖端的微小悬臂,感觉表面很像黑胶唱片针或轻敲它。无论是通过调整尖端高度还是敲击的共振频率,尖端和表面之间的相互作用都提供了可用于生成图像的信号。
虽然 AFM 图像为生物研究带来了巨大的好处,但当安藤俊雄和他在金泽大学的团队报告了一种高速运行的原子力显微镜时,这些研究能够再次提高档次。原子尺度分辨率的图像变成了电影,不仅可以带来结构,还可以了解动态。先前对有序蛋白质的研究,以及 IDP 促进染色质转录 (FACT) 蛋白,已确定该技术可用于对这些生物分子进行成像,而不会因尖端和样品之间的接触而导致数据失真。
内在无序的蛋白质
X射线晶体学的出现首次让研究人员清楚地了解了大量的生物分子结构。但是,自从 1930 年代和 1950 年代首次使用蛋白质晶体学技术以来,随着使用蛋白质晶体学分析了数十万个生物分子结构,越来越多的证据开始表明并非所有蛋白质都具有单一的结构。这些观察结果与由固定结构决定的蛋白质功能的普遍范式背道而驰。
在过去的 10 到 20 年中,这些本质上无序的蛋白质的普遍存在及其在从信号传导到转录调控和随后翻译的细胞功能中的重要性已得到广泛认可。在目前的工作中,研究人员研究的 IDP 包括聚谷氨酰胺束结合蛋白-1(PQBP-1,参与不同的过程,如前体 mRNA 剪接、转录调控、先天免疫和神经元发育)、自噬蛋白(参与去除功能失调的细胞成分)包含固有无序区域(IDR)和麻疹病毒核蛋白。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
大众CC作为一款备受关注的中型轿车,凭借其优雅的设计和出色的性能一直吸引着众多消费者的目光。2025款大众CC...浏览全文>>
-
2025款阜阳途锐新车正式上市,凭借其卓越的性能和豪华配置吸引了众多消费者的关注。这款车型以最低售价55 88...浏览全文>>
-
在准备购买一辆汽车之前,了解车辆的落地价格是非常重要的。所谓落地价,是指购车时除了车款之外还需要支付的...浏览全文>>
-
安徽淮南地区的长安启源E07作为一款备受关注的新能源车型,凭借其时尚的设计、丰富的配置以及出色的续航能力,...浏览全文>>
-
安徽淮南长安启源A05 2025款新车现已正式上市,这款车型以其高性价比和出色性能吸引了众多消费者的关注。作为...浏览全文>>
-
安徽阜阳地区的威然车型在近期进行了配置上的升级,对于想要购买这款MPV的消费者来说,这是一个值得关注的消息...浏览全文>>
-
随着汽车市场的不断发展,SUV车型因其宽敞的空间和多功能性受到了越来越多消费者的青睐。作为大众旗下的高端旗...浏览全文>>
-
安徽蚌埠地区想要购买长安启源E07这款新能源汽车的朋友,可以参考以下信息来做出更明智的选择。长安启源E07定...浏览全文>>
-
随着汽车市场的不断发展,2025款安庆高尔夫作为一款备受关注的车型,其价格和配置自然成为消费者热议的话题。...浏览全文>>
-
近期,安徽蚌埠地区的帕萨特车型迎来了新一轮的价格调整,其落地价再次创下新低,吸引了众多消费者的关注。作...浏览全文>>
- 悉尼最后几个年薪低于 10 万美元的郊区
- 2025 年新南威尔士州值得投资的地方
- 揭秘在澳大利亚买房需要多少收入
- 悉尼最后几个年薪低于 10 万美元的郊区
- 昆士兰有望成为澳大利亚房地产强国之一
- MSI 推出首款双模式 4K 曲面电竞显示器
- 飞利浦 Screeneo GamePix 900:在发布前进行预览
- 您会在这个奇怪的电动露营三轮车里露营吗
- Meross 推出支持 Matter 的智能恒温器
- 配备出色 3K OLED 显示屏的 Acer Swift 16 现已降价至史上最低价
- Acer Predator Helios 18 RTX 4080 游戏笔记本电脑 现优惠 725 美元
- VivoX200Pro视频和新样张揭示了200MP蔡司变焦相机的锐利眼睛可以达到多远
- 派对氛围天文爱好者又一次欣赏到极光秀
- iPhone16相机控制按钮有史以来最不苹果的东西
- 贾雷尔夸萨与利物浦签订新合同
- 首款在安兔兔上得分300万的手机拥有非常强大的SoC即将发布
- HumaninMotionRobotics的自平衡XoMotion外骨骼获得加拿大批准用于物理治疗
- 龙宫样本对之前关于富碳小行星形成的观点提出了质疑
- 凯文德布劳内伤情更新曼城球星的伤势进展和可能的回归日期
- 实验室实验表明用核武器轰炸一颗巨大的小行星可以拯救地球
