开发了反向光遗传学工具
波鸿鲁尔大学 (RUB) 的研究人员对一种新的光遗传学工具,一种可以受光控制的蛋白质进行了表征。他们使用了一种来自斑马鱼的视蛋白——一种存在于大脑和眼睛中的蛋白质,并将其引入小鼠的大脑中。与其他光遗传学工具不同,这种视蛋白不会被打开,而是被光关闭。实验还表明,该工具可能适用于研究导致癫痫发展的大脑变化。
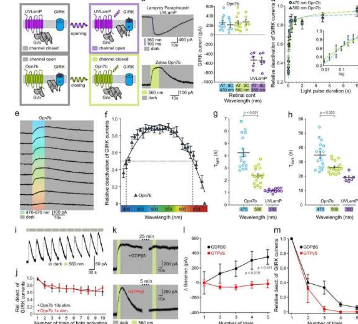
由行为神经生物学研究小组的 Melanie Mark 教授和普通动物学和神经生物学系的 Stefan Herlitze 教授领导的团队在 2021 年 7 月 23 日在线发表的《自然通讯》杂志上描述了这些实验和结果。
在各种条件下承担的角色
视蛋白 Opn7b 是一种 G 蛋白偶联受体,存在于斑马鱼中。与许多其他光激活 G 蛋白偶联受体不同,它可以在没有光刺激的情况下被激活,因此是永久激活的;研究人员称其为组成型活性。通常,G 蛋白偶联受体的激活导致某些离子通道的打开,从而导致离子流入细胞以及细胞中的进一步信号传递过程。在 Opn7b 的情况下,光会停用这个永久激活的信号链。
迄今为止,关于在没有刺激的情况下激活的 G 蛋白偶联受体的研究很少,尽管据推测它们在各种神经精神疾病和夜盲症中起作用。它们似乎也参与了病毒诱导的癌症的发展。
更精确地表征受体
Raziye Karapinar 博士、Ida Siveke 博士和 Dennis Eickelbeck 博士详细描述了 Opn7b 的功能,并且令他们惊讶的是,发现受体会被光灭活。相比之下,传统的光遗传学工具是通过光打开的。
研究人员认为 Opn7b 非常适合进一步了解组成型活性的 G 蛋白偶联受体的功能,并获得关于它们在疾病发展中的作用的新知识,其中受体可以以时间控制的方式进行检查在特定的细胞类型中。
癫痫发作
波鸿的研究人员 Jan Claudius Schwitalla 博士和 Johanna Pakusch 博士改变了小鼠大脑皮层中的某些细胞,从而产生了 Opn7b。如果他们用光使受体失活,就会触发动物的癫痫样活动,这种活动可以用光专门控制,并在其他光控制蛋白质的帮助下中断。研究人员希望有可能使用这种光遗传学工具更准确地了解癫痫发作发展的潜在机制和时间尺度。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
大众CC作为一款备受关注的中型轿车,凭借其优雅的设计和出色的性能一直吸引着众多消费者的目光。2025款大众CC...浏览全文>>
-
2025款阜阳途锐新车正式上市,凭借其卓越的性能和豪华配置吸引了众多消费者的关注。这款车型以最低售价55 88...浏览全文>>
-
在准备购买一辆汽车之前,了解车辆的落地价格是非常重要的。所谓落地价,是指购车时除了车款之外还需要支付的...浏览全文>>
-
安徽淮南地区的长安启源E07作为一款备受关注的新能源车型,凭借其时尚的设计、丰富的配置以及出色的续航能力,...浏览全文>>
-
安徽淮南长安启源A05 2025款新车现已正式上市,这款车型以其高性价比和出色性能吸引了众多消费者的关注。作为...浏览全文>>
-
安徽阜阳地区的威然车型在近期进行了配置上的升级,对于想要购买这款MPV的消费者来说,这是一个值得关注的消息...浏览全文>>
-
随着汽车市场的不断发展,SUV车型因其宽敞的空间和多功能性受到了越来越多消费者的青睐。作为大众旗下的高端旗...浏览全文>>
-
安徽蚌埠地区想要购买长安启源E07这款新能源汽车的朋友,可以参考以下信息来做出更明智的选择。长安启源E07定...浏览全文>>
-
随着汽车市场的不断发展,2025款安庆高尔夫作为一款备受关注的车型,其价格和配置自然成为消费者热议的话题。...浏览全文>>
-
近期,安徽蚌埠地区的帕萨特车型迎来了新一轮的价格调整,其落地价再次创下新低,吸引了众多消费者的关注。作...浏览全文>>
- 悉尼最后几个年薪低于 10 万美元的郊区
- 2025 年新南威尔士州值得投资的地方
- 揭秘在澳大利亚买房需要多少收入
- 悉尼最后几个年薪低于 10 万美元的郊区
- 昆士兰有望成为澳大利亚房地产强国之一
- MSI 推出首款双模式 4K 曲面电竞显示器
- 飞利浦 Screeneo GamePix 900:在发布前进行预览
- 您会在这个奇怪的电动露营三轮车里露营吗
- Meross 推出支持 Matter 的智能恒温器
- 配备出色 3K OLED 显示屏的 Acer Swift 16 现已降价至史上最低价
- Acer Predator Helios 18 RTX 4080 游戏笔记本电脑 现优惠 725 美元
- VivoX200Pro视频和新样张揭示了200MP蔡司变焦相机的锐利眼睛可以达到多远
- 派对氛围天文爱好者又一次欣赏到极光秀
- iPhone16相机控制按钮有史以来最不苹果的东西
- 贾雷尔夸萨与利物浦签订新合同
- 首款在安兔兔上得分300万的手机拥有非常强大的SoC即将发布
- HumaninMotionRobotics的自平衡XoMotion外骨骼获得加拿大批准用于物理治疗
- 龙宫样本对之前关于富碳小行星形成的观点提出了质疑
- 凯文德布劳内伤情更新曼城球星的伤势进展和可能的回归日期
- 实验室实验表明用核武器轰炸一颗巨大的小行星可以拯救地球
