研究人员开发了一种工程化的迷你CRISPR基因组编辑系统
CRISPR基因编辑的常见比喻是它像分子剪刀一样工作,剪下DNA的选定部分。斯坦福大学生物工程助理教授StanleyQi喜欢这个比喻,但他认为是时候将CRISPR重新想象为瑞士军刀了。
“CRISPR可以是简单的切割机,或者作为一个稳压器,编辑器,贴标机或成像仪更先进的。许多应用程序都从这个令人兴奋的新兴领域,”齐,谁也化学和助理教授说,系统生物学在斯坦福医学院和斯坦福大学化学-H研究所学者。
然而,许多不同的CRISPR系统正在使用或正在临床测试用于眼部、肝脏和大脑疾病的基因治疗,但它们的范围仍然有限,因为它们都存在相同的缺陷:它们太大,因此太难以输送到细胞、组织或生物体中。
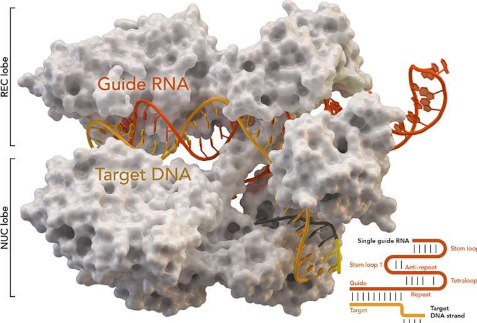
在9月3日发表在MolecularCell上的一篇论文中,Qi和他的合作者宣布了他们认为CRISPR向前迈出的重要一步:一种高效、多用途的迷你CRISPR系统。常用的CRISPR系统——Cas9和Cas12a等名称表示CRISPR相关(Cas)蛋白的各种版本——由大约1000到1500个氨基酸组成,而它们的“CasMINI”有529个。
研究人员在实验中证实,CasMINI可以删除、激活和编辑遗传密码,就像其更强大的对应物一样。其较小的尺寸意味着它应该更容易进入人体细胞和人体,使其成为治疗各种疾病的潜在工具,包括眼病、器官退化和遗传病。
坚持不懈的努力
为了使系统尽可能小,研究人员决定从CRISPR蛋白Cas12f(也称为Cas14)开始,因为它只包含大约400到700个氨基酸。然而,与其他CRISPR蛋白一样,Cas12f天然起源于古细菌——单细胞生物——这意味着它不太适合哺乳动物细胞,更不用说人类细胞或身体了。已知只有少数CRISPR蛋白无需修饰即可在哺乳动物细胞中发挥作用。不幸的是,CAS12f不是其中之一。这对齐这样的生物工程师来说是一个诱人的挑战。
“我们想,'好吧,数百万年的进化未能将这个CRISPR系统转变为在人体中发挥作用的东西。我们能在一两年内改变它吗?'”齐说。“据我所知,我们第一次将无效的CRISPR变成了有效的CRISPR。”
事实上,齐实验室的博士后学者、该论文的第一作者徐晓舒没有看到人体细胞中天然Cas12f的活性。Xu和Qi假设问题在于人类基因组DNA比微生物DNA更复杂且更难获得,这使得Cas12f很难在细胞中找到它的目标。通过查看Cas12f系统的计算预测结构,她仔细选择了蛋白质中大约40个可能绕过这一限制的突变,并建立了一次测试许多蛋白质变体的管道。理论上,一种有效的变体将通过激活其基因组中的绿色荧光蛋白(GFP)将人类细胞变成绿色。
“起初,这个系统在一年内根本不起作用,”徐说。“但经过生物工程的迭代,我们看到一些工程蛋白质开始发挥作用,就像魔法一样。这让我们真正体会到合成生物学和生物工程的力量。”
第一个成功的结果并不大,但他们让徐振奋并鼓励她继续前进,因为这意味着系统有效。经过许多额外的迭代,她能够进一步提高蛋白质的性能。“我们一开始只看到两个细胞显示绿色信号,现在经过工程改造,几乎每个细胞在显微镜下都是绿色的,”徐说。
“在某个时候,我不得不阻止她,”齐回忆道。“我说'现在很好。你已经制作了一个非常好的系统。我们应该考虑如何将这种分子用于应用。'”
除了蛋白质工程之外,研究人员还设计了将Cas蛋白引导至其目标DNA的RNA。对这两个组件的修改对于使CasMINI系统在人体细胞中发挥作用至关重要。他们测试了CasMINI在实验室人类细胞中删除和编辑基因的能力,包括与HIV感染、抗肿瘤免疫反应和贫血相关的基因。它对他们测试的几乎所有基因都起作用,对几个基因产生了强烈的反应。
开门
研究人员已经开始与其他科学家合作以寻求基因疗法。他们还对如何促进RNA技术的进步感兴趣——比如用于开发mRNA疫苗的技术——其中大小也可能是一个限制因素。
“自CRISPR早期以来,这种设计这些系统的能力一直是该领域所需要的,我觉得我们为实现这一目标做出了自己的贡献,”齐说。“而且这种工程方法可以提供如此广泛的帮助。这让我很兴奋——为新的可能性打开了大门。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
大众CC作为一款备受关注的中型轿车,凭借其优雅的设计和出色的性能一直吸引着众多消费者的目光。2025款大众CC...浏览全文>>
-
2025款阜阳途锐新车正式上市,凭借其卓越的性能和豪华配置吸引了众多消费者的关注。这款车型以最低售价55 88...浏览全文>>
-
在准备购买一辆汽车之前,了解车辆的落地价格是非常重要的。所谓落地价,是指购车时除了车款之外还需要支付的...浏览全文>>
-
安徽淮南地区的长安启源E07作为一款备受关注的新能源车型,凭借其时尚的设计、丰富的配置以及出色的续航能力,...浏览全文>>
-
安徽淮南长安启源A05 2025款新车现已正式上市,这款车型以其高性价比和出色性能吸引了众多消费者的关注。作为...浏览全文>>
-
安徽阜阳地区的威然车型在近期进行了配置上的升级,对于想要购买这款MPV的消费者来说,这是一个值得关注的消息...浏览全文>>
-
随着汽车市场的不断发展,SUV车型因其宽敞的空间和多功能性受到了越来越多消费者的青睐。作为大众旗下的高端旗...浏览全文>>
-
安徽蚌埠地区想要购买长安启源E07这款新能源汽车的朋友,可以参考以下信息来做出更明智的选择。长安启源E07定...浏览全文>>
-
随着汽车市场的不断发展,2025款安庆高尔夫作为一款备受关注的车型,其价格和配置自然成为消费者热议的话题。...浏览全文>>
-
近期,安徽蚌埠地区的帕萨特车型迎来了新一轮的价格调整,其落地价再次创下新低,吸引了众多消费者的关注。作...浏览全文>>
- 悉尼最后几个年薪低于 10 万美元的郊区
- 2025 年新南威尔士州值得投资的地方
- 揭秘在澳大利亚买房需要多少收入
- 悉尼最后几个年薪低于 10 万美元的郊区
- 昆士兰有望成为澳大利亚房地产强国之一
- MSI 推出首款双模式 4K 曲面电竞显示器
- 飞利浦 Screeneo GamePix 900:在发布前进行预览
- 您会在这个奇怪的电动露营三轮车里露营吗
- Meross 推出支持 Matter 的智能恒温器
- 配备出色 3K OLED 显示屏的 Acer Swift 16 现已降价至史上最低价
- Acer Predator Helios 18 RTX 4080 游戏笔记本电脑 现优惠 725 美元
- VivoX200Pro视频和新样张揭示了200MP蔡司变焦相机的锐利眼睛可以达到多远
- 派对氛围天文爱好者又一次欣赏到极光秀
- iPhone16相机控制按钮有史以来最不苹果的东西
- 贾雷尔夸萨与利物浦签订新合同
- 首款在安兔兔上得分300万的手机拥有非常强大的SoC即将发布
- HumaninMotionRobotics的自平衡XoMotion外骨骼获得加拿大批准用于物理治疗
- 龙宫样本对之前关于富碳小行星形成的观点提出了质疑
- 凯文德布劳内伤情更新曼城球星的伤势进展和可能的回归日期
- 实验室实验表明用核武器轰炸一颗巨大的小行星可以拯救地球
